http://www.apacame.org.br/mensagemdoce/66/apitoxina.htm
Engenheira química, doutora em bioquímica
LABM Pesquisa e Consultoria - amazile@labm.com.br
RESUMO
A apitoxina, veneno produzido pela abelha Apis mellifera, compõe-se principalmente de peptídeos e enzimas, quase todos fisiologicamente ativos, sendo historicamente reconhecida como instrumento valioso para o combate à artrite. Alguns polipeptídeos, especialmente a melitina, que representa cerca de 50% de seu peso seco, têm ação antiinflamatória mais potente que a cortisona e seus derivados, sobre os quais têm a vantagem adicional de ausência de efeitos colaterais. Atualmente, o produto atinge altíssimas cotações no mercado internacional. No Brasil, porém, seu emprego ainda é restrito e cercado de preconceitos, devido à falta de garantias sobre a sua pureza e risco de efeitos alérgicos. Neste trabalho, apresenta-se uma visão geral sobre os componentes, uso terapêutico e redução da alergenicidade da apitoxina
Palavras- chave: apitoxina, alergenicidade, terapia da artrite.
1 - INTRODUÇÃO
Diversos organismos produzem "veneno" como instrumento de defesa contra possíveis predadores. As ações fisiológicas são variadas, podendo imobilizar ou até matar a presa (38). O primeiro registro de morte humana atribuída a veneno de inseto (vespa) foi o do Rei Menés do Egito, cerca de 2.600 anos AC (8).Bem abaixo das doses agressivas, os "venenos" podem ter ações fisiológicas desejáveis e até terapêuticas. As propriedades anti-artríticas da apitoxina, o veneno produzido pela abelha Apis mellifera, são reconhecidas há muitos séculos. Há cerca de 2.500 anos, Hipócrates já empregava ferroadas de abelha em seus procedimentos terapêuticos. No século II de nossa era, outro médico grego, Galeno, escreveu sobre o tratamento com veneno; Carlos Magno, no século VIII, foi tratado com ferroadas de abelha para combater suas inflamações nas juntas (8).Nos últimos anos, devido à comprovação científica dos seus efeitos terapêuticos, a procura tem aumentado em diversos países, elevando consideravelmente a cotação da apitoxina no mercado internacional (67). No entanto, apesar do peso do setor apícola nacional, a participação brasileira neste mercado tem-se mantido muito aquém de suas potencialidades.
Com o objetivo de contribuir para o aumento do emprego terapêutico da apitoxina brasileira, apresenta-se uma revisão sobre a composição química, valor terapêutico e recursos para redução de sua alergenicidade.
2- TERAPIA DA ARTRITE E RISCO ALÉRGICO
A apitoxina tem uma aplicação muito importante no tratamento da artrite, doença que causa dores intensas, restringe os movimentos e até deforma o paciente. Largamente disseminada em todo o mundo, pode advir de desgaste natural, esforços excessivos, envelhecimento ou ainda problemas na circulação, acarretando inflamação das juntas e erosão das cartilagens. Não tem cura e pode evoluir para a invalidez (8). As terapias tradicionais passam pelo uso de sais de ouro e de antiinflamatórios não-esteróides (aspirina, ibuprofeno e fenilbutazona...) e esteróides (cortisona, prednisona e dexametasona...) (15). Todas elas têm efeitos colaterais, acentuados devido à necessidade de tratamento permanente. Em especial, as drogas esteróides podem acarretar impotência, edema, queda da resposta imunológica, crescimento excessivo dos cabelos e irregularidades cardíacas (8).
Pelo emprego da apitoxina, vários pesquisadores já demonstraram que é possível reverter a evolução da doença sem ocorrência de efeitos colaterais (12, 18, 60). A título de ilustração, KIM (29) acompanhou um grupo de 108 pacientes artríticos que não tinham obtido sucesso nas terapias tradicionais e que foram tratados com veneno de abelha duas vezes por semana durante seis semanas. Segundo o autor, nenhum efeito colateral foi observado e a maioria dos pacientes mostrou uma melhoria acentuada nos sintomas.Apesar disso, embora já largamente difundido nos países do leste europeu, o emprego da apitoxina ainda enfrenta preconceitos na medicina ocidental, geralmente atribuídos a riscos de efeitos tóxicos e de reações alérgicas (37). A reação normal à apitoxina consiste de uma dor aguda no local da picada, que dura apenas alguns minutos; em algumas pessoas pode ocorrer também reação na vizinhança da picada, com aparecimento de edema, rubor, calor ou coceira, que persistem durante algumas horas.Com efeito, alguns polipeptídeos da apitoxina são referidos como "toxinas" porque atuam sobre os mastócitos do tecido conjuntivo e os basófilos sanguíneos, liberando grânulos carregados de aminas biogênicas, especialmente a histamina. Geralmente a influência da histamina liberada pelos mastócitos perdura apenas alguns minutos. Efeitos tóxicos só advêm de doses excessivas, associadas a um número muito grande de picadas em regiões intensamente vascularizadas (59, 60). Nesses casos, vários mediadores vasoativos podem continuar sendo produzidos durante horas, mantendo as alterações de permeabilidade vascular e vasodilatação (15, 46).Diferentemente dos efeitos tóxicos, os efeitos alérgicos, que se estima atingirem cerca de 1% da população, podem advir de pequeníssimas dosagens de apitoxina e estão relacionadas principalmente às suas proteínas de alto peso molecular. Nas pessoas alérgicas, ou hipersensíveis, as reações podem variar desde sensação de desconforto até edema espalhado, dificuldade de respiração, constrição do peito, fraqueza intensa, cólicas, náuseas e vertigens. O caso extremo é o choque anafilático que, se não for tratado rapidamente, pode ser fatal (46).As reações alérgicas estão associadas à ativação do sistema imune através de antígenos. Segundo NEGREIROS et al. (46), as substâncias alérgicas têm peso molecular acima de 10.000; entre 10 e 40 mil são antígenos fracos e somente acima de 40 mil são antígenos fortes. Polipeptídeos com peso molecular abaixo de 10.000 não são antígenos, embora possam agir como tal se ocorrerem ligações com adjuvantes, que podem ser proteínas do próprio organismo (46). Em qualquer caso, a chance de ativação de anticorpos está fortemente relacionada à existência e preservação da estrutura terciária da molécula antigênica (46). Neste sentido, entende-se que as enzimas (todas com PM acima de 10.000) sejam os componentes mais alergênicos da apitoxina. Entende-se também que os polipeptídeos da apitoxina, com pesos moleculares predominantemente na faixa de 2 a 3 mil, tenham um potencial alergênico baixo, com riscos equivalentes aos de outras drogas de largo uso, como a insulina.
Com efeito, as reações alérgicas são geralmente associadas às enzimas da apitoxina (9, 26, 29). Dentre elas, a fosfolipase A2 é a mais alergênica, seguindo-se a hialuronidase e a fosfatase ácida (29).
3- COMPOSIÇÃO QUÍMICA
A apitoxina é uma mistura complexa de compostos nitrogenados, que correspondem a mais de 90% do seu peso seco. Na Tabela 1 encontram-se relacionados seus principais componentes, agrupados por faixas de peso molecular.
Observa-se que os componentes nitrogenados com peso molecular abaixo de 1000 consistem principalmente de pequenos peptídeos e monoaminas. Na faixa entre 1 e 10 mil encontram-se numerosos polipeptídeos, com amplo predomínio da melitina. Acima de 10 mil ocorrem diversas enzimas, com amplo predomínio da fosfolipase A2. No total, a apitoxina contém cerca de 20 substâncias ativas.
3.1- MONOAMINAS
Do ponto de vista farmacológico, as monoaminas da apitoxina são referidas como "aminas biogênicas", atuando como vasodilatadores e neurotransmissores. Estas substâncias ocorrem naturalmente em todos os organismos vivos e, nos níveis presentes na apitoxina, não representam potencial tóxico (30, 43, 46).A histamina (b -imidazol-etilamina) é um potente vasodilatador. Promove a secreção de pepsina e de ácido pelo estômago, com poderosa ação estimulante da secreção gástrica. No teor em que ocorre na apitoxina não tem qualquer efeito tóxico. A dose letal em ratos (LD50) é de 2020 mg/kg de peso (10), o equivalente a mais de 100 g para um adulto com 50 kg de peso. Na apitoxina, a maior parte da histamina presente encontra-se ligada a peptídeos, com destaque para as estruturas referidas como procamina A, procamina B e peptídeo de Nelson (Figura 1).
Existe a possibilidade de "choque histamínico" pela apitoxina. Contudo, o risco não se encontra relacionado ao conteúdo de histaminas do próprio veneno, mas sim à grande quantidade de histaminas liberadas pela própria vítima, quando uma quantidade excessiva de veneno promove o rompimento das membranas de grande número de mastócitos e basófilos.
Peptídeo de Nelson Figura 1- Histaminas presentes na apitoxina |
A dopamina [a -(3,4-hidroxifenil)-b -aminoetano] e a noradrenalina são catecolaminas de ocorrência natural que atuam na estimulação dos receptores de adrenalina. Potentes neurotransmissoras, são muito usadas em procedimentos terapêuticos, estimulando a vascularização, vasodilatação e excreção de sódio (15,46). Doses excessivas, porém, provocam vasoconstrição, elevando a pressão arterial. A apitoxina contém ainda pequeníssimas quantidades de outros neurotransmissores, como a serotonina e a norepinefrina, que têm efeitos fisiológicos bem conhecidos (10).
3.2 - POLIPEPTÍDEOS
A apitoxina contém aminoácidos isolados (cerca de 1%) e oligopeptídeos (14%) com peso molecular abaixo de 1.000. Os polipeptídeos ativos têm peso molecular acima de 1.000, sendo que os mais importantes têm cadeias entre 18 e 25 aminoácidos (34).
3.2.1- MELITINA
A melitina é uma substância de elevada ação anti-inflamatória, sendo considerada o principal agente da apitoxina na terapia da artrite. Junto com a apamina, a melitina estimula os sistemas adrenal e pituitário a produzirem cortisol e outros esteróides naturais, que têm importante papel na terapia da artrite e não produzem as complicações médicas associadas aos esteróides sintéticos (66, 79).Trata-se de um peptídeo formado por 26 aminoácidos (Figura 2) dos quais dez são fortemente hidrofóbicos e seis são positivamente carregados em pH neutro. Por isso tem fortes propriedades tensoativas. Geralmente se considera o teor médio de melitina como 50% do peso seco da apitoxina (44), mas sabe-se que este valor pode variar bastante, conforme a procedência. Por outro lado, não existe grande diferença nos teores de melitina em venenos de abelhas européias e africanas (61).
Gly (+)-Ile-Gly-Ala-Val5-Leu-Lys(+)-Val-Leu-Thr10-Thr- Gly-Leu-Pro-Ala15--Leu-Ile-Ser-Trp-Ile20-Lys(+)-Arg(+)-Lys(+)-Arg(+)-Gln25-Gln-NH2 Figura 2 - Estrutura da melitina (PM = 2846,5) |
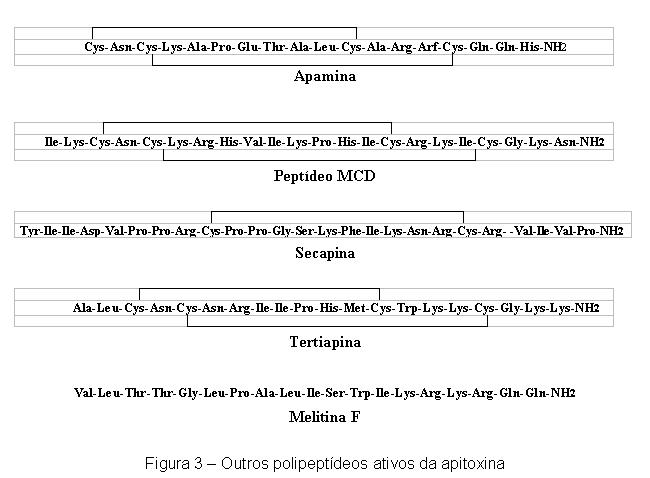
Entre os outros polipeptídeos da apitoxina (Figura 3) destacam-se a apamina (2%), o peptídeo MCD (2%), cardiopep (0,7%), secapina (0,5%), tertiapina, (0,1%) e a melitina F (< 0,1%) (29).A ação fisiológica da apamina está associada a modificações na noradrenalina, dopamina e serotonina e interferência nas transmissões sinápticas, entre outras. Como a melitina, também estimula a função hipofisocorticorenal, acarretando aumento agudo imediato dos níveis de cortisol no sangue (8,9).O peptídeo MCD (do inglês "mast cell degranulating") como o próprio nome diz, induz a degranulação dos mastócitos, células de defesa do organismo, acarretando a liberação de heparina (que impede a coagulação do sangue) e histaminas (vasodilatadores). Daí resulta uma ação antiinflamatória, considerada 100 vezes mais potente que a cortisona, em doses equivalentes (5).Similarmente, testes em cachorros e macacos demonstraram que o cardiopep, além de estimular as glândulas adrenais para liberar hormônios endógenos, atua diretamente sobre o miocárdio, aumentando tanto a força de contração como o ritmo cardíaco, com um efeito pequeno ou nulo sobre a circulação coronária. Esta fração apresenta, além disso, propriedades anti-arrítmicas em corações isolados ou intactos (9).
3.3 - ENZIMAS
Existem várias enzimas na apitoxina. Devido à sua faixa de peso molecular, todas são potencialmente alergênicas. As mais destacadas na literatura, porém, são a fosfolipase A2, a hialuronidase e a fosfatase ácida.
3.3.1- FOSFOLIPASE A2
Fosfolipase A2 é o nome atribuído a todas as enzimas capazes de retirar, por meio de hidrólise, o ácido graxo situado na posição 2 da molécula de lecitina e substratos similares (fosfodiacilgliceróis), substâncias largamente presentes nas membranas celulares (30). Esta enzima está naturalmente presente em todos os seres vivos (19), sendo que os pesos moleculares, as estruturas químicas e funções paralelas a ela associadas variam acentuadamente conforme o organismo produtor, acarretando os mais diversos espectros de efeitos fisiológicos. Dependendo da origem, a fosfolipase A2 pode acarretar efeitos anticoagulantes e inflamatórios, por exemplo. No entanto, estas ações tóxicas estão relacionadas a porções da molécula distintas do centro ativo responsável pela atividade enzimática (17, 26, 41, 42, 48).Na apitoxina existem duas estruturas de fosfolipase A2, ambas com peso molecular da ordem de 11.000 e estruturas bem caracterizadas (2, 4, 6,17, 63, 64, 65, 73). Usualmente considera-se o teor médio de 12% mas, segundo SCHUMACHER et al. (61), as concentrações podem variar de 1,8 a 27,4% p/p, sendo geralmente maiores nas abelhas africanas que nas européias.
Em pequenas doses, a fosfolipase A2 da apitoxina não apresenta danos, exceto para pessoas alérgicas. Em doses elevadas (por exemplo, associadas a centenas de picadas simultâneas) ocorrem efeitos tóxicos associados à inibição da agregação de plaquetas (21, 76, 82), necroses nas células do músculo esquelético (49, 51) e do pâncreas (41). Esta enzima tem sido alvo de grande número de estudos. Atualmente, com base em inúmeros trabalhos sobre mecanismos de defesas imunológicas à fosfolipase A2 (1, 11, 16, 27, 28, 39, 47, 69) existem vários procedimentos descritos para testes de hiper-sensibilidade e para terapia de imunização (6, 27, 43, 44, 48, 62).
3.3.2- OUTRAS ENZIMAS
A hialuronidase é uma enzima que atua sobre o ácido hialurônico, importante componente do tecido conetivo. Com isso, propicia a difusão dos demais componentes do veneno, sendo referida como "fator de espalhamento." Na apitoxina, esta enzima é uma glicoproteína, sendo que a parte proteica tem peso molecular em torno de 40.000 (349 aminoácidos) (13, 23, 77).
A fosfatase ácida da apitoxina (1%) é considerada o principal alergênico em 18% dos pacientes alérgicos (5, 28, 29). Esta enzima está associada à liberação de histamina dos basófilos humanos, além de produzir inflamação e ardor na pele.
4- REDUÇÃO DA ALERGENICIDADE
4.1- FRACIONAMENTO
Os componentes mais alergênicos da apitoxina são as enzimas com peso molecular acima de 10.000 e os de interesse terapêutico são cadeias com peso molecular entre 2 e 3 mil, além de outros ainda menores. Partindo desta premissa, pode-se conseguir uma drástica redução da alergenicidade do veneno de abelha mediante técnicas de fracionamento por peso molecular, como a cromatografia em coluna (34), a diálise e a ultrafitração (81). Em trabalho recente (35, 36) a cromatografia de várias amostras de apitoxina brasileira em coluna de Sephadex G-50 fine resultou em três frações, sendo que os componentes com peso molecular até 7.000 se concentraram na terceira fração. É possível obter frações com faixas de peso molecular cada vez mais estreitas, mediante o fracionamento sucessivo em colunas de porosidade cada vez menor (72).
4.2- EFICIÊNCIA
A eletroforese em gel um recurso rápido e adequado para análise da pureza e faixas de peso molecular das frações da apitoxina (3, 14, 22, 35, 53,58). Segundo RAMES & RICKWOOD (53), embora as separações em gel bidimensionais tenham maior poder de resolução, a eletroforese unidimensional ainda é a mais largamente difundida. Alem de permitir determinar o peso molecular de todos os componentes da apitoxina (58), ajusta-se a procedimentos para determinação de atividade enzimática (24, 70).Se o objetivo do fracionamento é reduzir sua alergenicidade, um parâmetro importante para avaliar a eficiência do procedimento é a dosagem da enzimática residual nas frações. Neste sentido, a medida da atividade da fosfolipase A2 é a mais importante, por se tratar do principal alergênico da apitoxina, e que está presente em maior proporção. Além disso, no caso do fracionamento por tamanho, a comprovação da retirada desta enzima é uma garantia da ausência das demais.Existem diversas formas para se determinar a atividade fosfolipásica. As técnicas baseiam-se no efeito direto da enzima, que é o aumento da acidez decorrente da liberação de um ácido graxo da lecitina e similares (34) ou em efeitos indiretos, como a variação do tempo de coagulação das proteínas da gema de ovo na presença e ausência da enzima (32, 75). Para amostras muito pequenas existem técnicas de fluorescência (54) e eletroforese (50) , entre outras.
Para a atividade da hialuronidase também existem opções baseadas na eletroforese em placa de gel (13), turbidimetria (52) e espectrofotometria (7,31, 33, 77) sendo estas últimas as mais utilizadas. A atividade hemolítica é um parâmetro muito empregado como referencial de controle da apitoxina (32, 55). Contudo, como resulta das ações conjugadas da fosfolipase A2, da melitina e outros peptídeos (34), a medida desta atividade não permite avaliar a eficiência do fracionamento do veneno.
5- CONCLUSÃO
A aplicação terapêutica da apitoxina já foi amplamente comprovada. Não se trata de uma opção desprovida de riscos, mas existem recursos tecnológicos para que sejam amplamente minimizados. Riscos mais graves encontram-se associados às terapias tradicionais da artrite com esteróides.Sob a óptica financeira, a apitoxina é uma fonte valiosa de divisas, cujo aproveitamento está muito abaixo de suas potencialidades, apesar da posição de destaque já ocupada pela apicultura brasileira no mercado mundial, principalmente através da própolis. Isto se deve às dificuldades ainda encontradas no Brasil para o fracionamento adequado da apitoxina e até mesmo para o fornecimento de garantias de autenticidade e pureza do produto in natura.
Com este trabalho, espera-se estimular novos estudos sobre a apitoxina no Brasil. Neste sentido, enfatiza-se a importância de formação de grupos interdisciplinares, para se assegurar tanto a eficiência dos métodos de fracionamento como a garantia da ação terapêutica.
6- REFERÊNCIAS
- AKDIS,C.A et al.. J. Allergy Clin. Immunol., 99 (3): 345-53. 1997.
- AMERATUNGA R. V. et al. Pathology, 27 (2): 157-60. 1995.
- ANDREWS, A.T. Electrophoresis: Theory, Techniques and Biochemical and Clinical Applications. 2 ed. New York, Oxford Univ. Press, 1986.
- ANNAND, R. R et al. Biochemistry, 35 (14): 4591-601. 1996.
- BILINGHAN et al (1973). Apud: BLUM, M. S. Chemical defenses in arthropods. New York, Academic Press, 1981. 562 p.
- BLASER, K. et al. Int. Arch. Allergy Immunol., 117 (1): 1-10. 1998 .
- BONNER & CANTEY (1965). Apud: WAYBE et al. Methods in Enzimology, 235: 606-12. 1994.
- BROADMAN, J. Bee Venom - The Natural Curative for Arthritis and Rheumatism. New York, Putnam & Sons. 1962. 224 p.
- BROOKS, R. et al. Estudios sobre el veneno de abejas. Habana, Universidad de la Habana, 1994. 11 p.
- BUDAVARI, S. ed. The Merck Index. Raway, Merck Res. Lab., 1996.
- CARBALLIDO, J.M. et al. Eur.J. Immunol. ,27 (2): 515-21. 1997.
- CHANG,Y. H. & BLIVEN, M. L. Agents Actions, 9: 205-11. 1979.
- CHEN, S. S. et al. Clin. Chim. Acta, 95 (2): 277-84. 1979.
- CHETTIBI, S. & LAWRENCE, A. Toxicon, 27 (7): 781-7. 1989.
- COUTINHO, A.C. Dicionário Enciclopédico de Medicina. 3 ed. Lisboa, Argo Ed., 1970. 4 v.
- DEREGNAUCOURT, C. & SCHREVEL, J. J. Biol Chem., 275 (51): 39973-80. 2000.
- DHILLON, M et al. J. Allergy Clin. Immunol., 90 (1): 42-51. 1992.
- EISEMAN,J. L. et al. Biochem. Pharm., 31:1139-46. 1982.
- GARCIA-PASTOR, P. et al. J. Pharmacol. Exp.Ther. 289 (1): 166-72.1999.
- GRENIER, D.& MICHAUD, J. J. Clin. Microbiol: 31 (7): 1913-15. 1993.
- HAKALA,J.K. et al. Thromb.Vasc-Biol., 19 (5): 1276-83. 1999.
- HAMES, B.D. & RICKWOOD, D. Gel electrophoresis of proteins. 2 ed. Oxford, IRL Press, 1990.
- HARRISON, R. A. Biochem. J.: 252 (3): 875-82. 1988.
- HOFFMANN, W.J. et al. Arch. Biochem. Biophys.: 221: 361-70. 1983.
- HOLLANDER, T. et al. Carbohydr-Res. 247291-7. 1993.
- ISHEY et al., 1975. Apud: MEYER, W.L. Most Toxic Insect Venom in: University of Florida Book of Insect Records. Florida, University of Florida, 1996.
- KAMMERER,-R. et al. Clin. Exp. Allergy, 27 (9): 1016-26. 1997.
- KETTNER, A. et al. Clin. Exp. Allergy, 29 (3): 394-401. 1999
- KIM, C. M.M. Bee venom therapy and bee acupuncture therapy. Korea, South Korean Ed., 1992.
- LEHNINGHER, A L. Bioquímica. Sãp Paulo, Edgard Blucher, 1976. 4 v.
- LIEN, Y. H. et al. Biochim. Biophys. Acta, 1034 (3): 318-25 . 1990.
- LORENZO, M.M.L. et al. Propiedades farmacológicas del veñeno de abejas y caracterizacion parcial de uno de sus componentes: la fosfolipasa A2. Havana, Universidad de la Habana, 1990.
- LYON, M. & PHELPS, C.F. Biochem. J., 199 (2): 419-26. 1981.
- MAIA, A.B.R.A. Desenvolvimento Tecnológico da Apitoxina Nacional. Belo Horizonte, CNPq/RHAE, LABM, 2001. (Rel. Técnico)
- MAIA, A.B.R.A. ROCHA, M.P.S. Fracionamento e Caracterização da apitoxina. Mensagem Doce, Apacame, São Paulo, 2002. (no prelo).
- MAIA, A.B.R.A et al. Fracionamento e aferição da pureza da apitoxina. Caxambu,, BRAZMEDCHEM. 1o Simpósio Brasileiro em Química Medicinal, 11-16/11/2001.
- MALONE, F. Bees Don't Get Arthritis. New York: Dutton. 1979. ISBN 0-914960-60-1. 179 p.
- MEYER, W.L. Most Toxic Insect Venom. In: University of Florida Book of Insect Records. Florida, University of Florida, 1996. Cap. 23.
- MICHILS, A et al. J. Allergy Clin.Immunol. 102 (1): 118-26. 1998.
- SEEGER, M. et al. Eur. J. Immunol., 28 (7): 2124-30. 1998.
- MOSSNER, J. et al. Int. J. Pancreatol., 27 (1): 29-38. 2000.
- MUKHOPADHYAY, A. & STAHL, P. Arch. Biochem. Biophys., 324(1): 78-84. 1995.
- MULLER, U. et al. Clin. Exp. Allergy, 27 (8): 915-20. 1997.
- MULLER, U. et al. J. Allergy Clin. Immunol.,101 (6 Pt 1): 747-54. 998.
- NAIR, B. et al.. Toxicon, 17: 557-69. 1979.
- NEGREIROS, E.B. et al. Alergia para Clínicos e Pediatras. Rio de Janeiro, Atheneu, 1987.
- NICOLAS, J. P. et al. J. Biol. Chem. 14; 272 (11): 7173-81. 1997.
- OKANO, C.L. et al. Allergy, 54 (8): 811-8. 1999.
- OWNBY, C.L. et al. Toxicon. 35 (1): 67-80. 1997.
- PACAKOVA, V. & STULIK, K. JAOAC, 83 (3): 549-54. 2000.
- PETROIANU,G. et alli. Am. J. Emerg. Med.,18 (1): 22-7. 2000.
- PLATER, G. et al. Toxicon, 33: 157-69. 1995.
- RAMES, B.D. & RICKWOOD, D. Gel Electrophoresis of Proteins. 2 ed. Oxford, IRL, 1990.
- RICHIERI, G. V. & KLEINFELD, A. M. Anal Biochem.: 229 (2): 256-63. 1995.
- ROSARIO & OKASAKI (1980). Apud: SCHMIDT, J. O. Toxicon, 33 (7): 917-27. 1995.
- ROTHFELD, G. Bee Venom Therapy. http://www2.shore.net/~spectrum/welcome.html
- SCHUMACHER, M. J. et al. J. Allergy Clin Immunol., 90 (1): 59-65. 1992.
- SHAPIRO, A.L. et al. Biochem. Biophys. Res. Commun., 28: 815, 1967.
- SCHMIDT, D.K. et al. Prostaglandins, 16 (2): 233-8. 1978
- SCHMIDT, J. O. Toxicon, 33 (7): 917-27. 1995.
- SCHUMACHER, M.J. et al. Am. J. Trop. Med. Hyg. , 55 (2): 197-201. 1996.
- SCHUMACHER, M.J. et al. J. Allergy Clin. Immunol., 90 (1): 59-65. 1992.
- SCOTT, D. L. et al. Science: 250 (4987): 1541-6. 1990.
- SCOTT, D. L. et al. Science, 250 (4987): 1563-6. 1990.
- SCOTT,-D. L et al. Science, 252 (5007): 764. 1991.
- SHKENDEROV & KOBUROVA,1979. Apud: WILKINSON, S. Bee Culture Magazine. http://www.airoot.com/beedevelop/index.htm
- SIMICS,M. Canadian Beekeeping, Vol. 18(6): 140. 1994.
- SMITH, R.F. & WILLETT, N.P. Applied Microbiol., 16: 1434. 1968. Apud: WAYBE et al, Methods in Enzimology, 235: 606-12. 1994.
- SPECHT, C. & KOLSCH, E. Int. Arch. Allergy Immunol., 112 (3): 226-30. 1997.
- SRI VENUGOPAL, K.S. & ADIGA, P.R. Anal. Biochem., 101: 215. 1980.
- SULTANA, G.N. et al. Biotechnol. Appl. Biochem., 21 ( Pt 1): 101-10. 1995.
- SZOKAN., G. et al.. J. Liquid Chromatog.: 17(16): 333-49. 1994.
- VALENTIN, E. et al. J. Biol. Chem., 275 (11): 7492-6. 2000.
- VIDAL, J.C. & STOPPANI, A.O.M. Experientia, 26; 831-2. 1970.
- VIDAL, J.C. & STOPPANI, A.O.M. Arch. Biochem. Biophys.,145: 543-6. 1971.
- WATALA, C. et al. Comp. Biochem. Physiol., 97 (1): 187-94. 1990.
- WAYBE et al. Methods in Enzimology, 235: 606-12. 1994.
- WEBER, A. et al. Allergy, 42 (6): 464-70. 1987.
- WILKINSON, S. Bee Culture Magazine. 2002. http://www.airoot.com/bee develop/index.htm
- WOLF, R. A et al. Am. J. Cardiol., 15; 53 (7): 941-4. 1984.
- YANG, T. & ZALL. (1984). Apud: GOLDSTEIN, W.E. et al. Biochemical Engineering VI, 589 (Pt. 4): 192- 260. 1990.
- YUAN, Y. et al. Blood, 86 (11): 4166-74. 1995.




Nenhum comentário:
Postar um comentário